Histoquímica, Fitoquímica, Química Computacional y Bioactividad de los monoterpenos irregulares de la "carqueja", Baccharis trimera (Less.) DC.
Presentación oral en el IX Congreso Latinomaricano de Plantas Medicinales (COLAPLAMED). 13-15 de Octubre de 2021 (Virtual)
Área temática: Fitoquímica y actividad biológica in vitro de compuestos bioactivos a partir de plantas medicinales
Manuel Minteguiaga, 1,2* Silvia A.
Brandán, 3 María I. Mercado, 4 Ana M. Torres, 5
Graciela Ponessa, 4 Gabriela L. Ricciardi, 5 César A. N.
Catalán, 3 Eduardo Dellacassa 1
1 Biotecnología de Aromas, UdelaR, Montevideo, URY; 2 Ciencia-Tecnología
Química, UdelaR, Tacuarembó, URY; 3 Bioquímica, Química y Farmacia,
UNT, Tucumán, ARG. 4 Morfología Vegetal, Fundación Lillo, Tucumán, ARG.
5 Productos Naturales, UNNE, Corrientes, ARG.
*manuel.minteguiaga@pedeciba.edu.uy
Palabras clave: Baccharis trimera, “carqueja”, monoterpenos irregulares, bioactividad.
Introducción: Baccharis trimera (Less.) DC. (Asteraceae) (Bt, “carqueja”), es una de las plantas medicinales icónicas de Sudamérica, empleada en infusiones y/o decocciones para tratar malestares hepato-gástricos [1]. Su potencial farmacológico validado incluye propiedades antioxidantes, antiinflamatorias, digestivas, alexitéricas, antimicrobianas y antiparasitarias; asociadas a metabolitos pertenecientes a la fracción fija (FF) (flavonoides, ácidos cafeoilquínicos, di- y triterpenos) [1]. En cambio, la fracción volátil (FV, aceite esencial; obtenida mediante destilación), constituida por mono- y sesquiterpenos, ha sido escasamente evaluada en cuanto a su bioactividad.
Metodología:
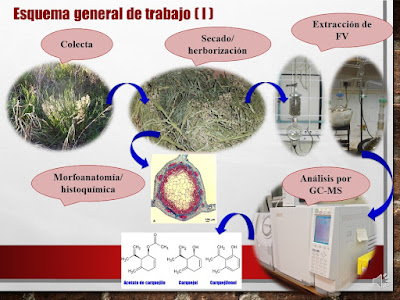
En este trabajo se estudiaron los monoterpenos
irregulares (MIs) de la FV de Bt nativa de Uruguay, y su bioactividad.
Para ello se histo-localizaron, mediante microscopía óptica y tinción (NADI y
Sudan IV) los sitios de síntesis y acumulación de la FV, y se obtuvo y
caracterizó la misma por hidro-destilación y GC-MS [2]. Mediante cromatografía
líquida se aisló acetato de carquejilo (I, Figura 1), principal MI de la
FV, que fue utilizado para obtener los constituyentes minoritarios carquejol y
carquejifenol (II y III, repectivamente, Figura 1) [3]. I,
II y III fueron identificados mediante espectroscopía (1H-RMN,
13C-RMN, IR, UV, DC, Raman, EI-MS). Se realizaron también cálculos
de química computacional (método DFT; funcional B3LYP) para predecir sus
propiedades moleculares e identificar los posibles sitios de reactividad
biológica [3]. Los estudios de bioactividad in vitro incluyeron:
alexitérica contra el veneno de la serpiente Bothrops diporus
(inhibición de actividad proteolítica y hemolítica; entre otros), y
antiradicalaria (DPPH).
Figura. 1. acetato de carquejilo (I), carquejol (II) y carquejifenol (III) (izquierda a derecha).
Resultados y discusión: La FV de Bt se ubicó en tricomas glandulares biseriados y conductos esquizógenos [2]. La FV, II y III inhibieron moderadamente la proteólisis; y II presentó una leve inhibición de la hemólisis (10,5%) producida por el veneno de B. diporus. La FV y III presentaron escasa actividad antiradicalaria (inhibición < 8,5%). Los valores obtenidos fueron parcialmente comparables a los de la FF de Bt [4].
Conclusiones: Se destaca la importancia de seguir evaluando los MIs de Bt como
fuente de productos bioactivos. En efecto, II se ha descripto como
eficaz agente antipirético, y potenciador de hipnóticos: sus mezclas con
codeína son tan efectivas como la morfina [5].
Agradecimientos: ANII/AUGM/PEDECIBA
Referencias bibliográficas
[1]. Rabelo, A.C.S; Costa D.C. (2018). Chem. Biol. Interact. 296: 65-75.
[2]. Minteguiaga, M. et
al. (2018). Ind.
Crops Prod. 112:
488-498.
[3]. Minteguiaga, M. et
al., (2017). J. Molec. Struct. 1150, 8-20. Minteguiaga, M. et al.,
(2018). J. Molec. Struct. 1165: 332-343. Minteguiaga, M. et al., (2019). J. Molec. Struct. 1177: 499-510.
[4]. Minteguiaga, M. et
al., (2017). V ENAQUI. PEDECIBA. Montevideo/Uruguay,
10/2017, Póster No. 102.
[5]. Naves Y.R, Caujolle F. (1963). Therapeutic d-ortho-menthatriene-1(7),5,8-ol-3. US Patent.
3112245.












Comentarios
Publicar un comentario