Nuevos poliacetilenos C9 del aceite esencial de la especie altamente amenazada Baccharis palustris Heering (Asteraceae)
Resumen del artículo. DOI: 10.1016/j.phytol.2022.01.012
Phytochemistry Letters 2022, 48: 106-113.
Resumen
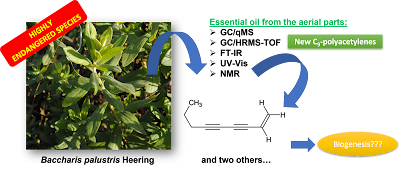
La composición del aceite esencial de las partes aéreas de Baccharis palustris Heering (Asteraceae), una especie altamente amenazada, se analizó mediante GC/qMS, GC/HRMS-TOF, FT-IR, UV–vis y espectroscopía de RMN, empleando técnicas monodimensionales y bidimensionales. En nuestro conocimiento, este es el primer reporte sobre la composición del aceite esencial de B. palustris, así como el primer estudio fitoquímico sobre la especie. Los extractos volátiles se obtuvieron en diferentes estadíos fenológicos de la planta, floración (F) y vegetativo (V), de los cuales se identificaron 51 componentes totalizando 96,3% y 99,0% del aceite, respectivamente. El mismo fue altamente concentrado en poliacetilenos (> 75%), con los principales de ellos siendo nuevos como productos naturales (no reportados con anterioridad): los componentes de 9 carbonos 1-nonen-3,5-diino (aquí nombrado como baccharisdiino) (52,7-65,0%), 1,7(Z)-nonadien-3,5-diino [7(Z)-dehidro-baccharisdiino] (14,4-17,8%), y 1,7(E)-nonadien-3,5-diino [7(E)-dehidro-baccharisdiino] (1,5-2,4%) (Figura 1). Además, los compuestos poliacetilenos (Z)- y (E)-metil ésteres de lachnophyllum (4,3-5,3% y 0,2%, respectivamente, Figura 1) previamente reportados también fueron identificados en B. palustris. Además, los análisis mediante GC/qMS permitieron la identificación de otros 46 componentes en estas muestras de aceite, principalmente mono- y sesquiterpenoides. En B. palustris, estos C9-poliacetilenos identificados probablemente deriven biogenéticamente del precursor C10: baccharisdiino podría provenir de uno o ambos de los ésteres de lachnophyllum isómeros, por hidrólisis enzimática seguida de descarboxilación (Figura 2). Los dehidro-baccharisdiinos se podrían originar de una manera similar partiendo de los correspondientes isómeros de los ésteres de matricaria (Figura 2), uno de los cuales fue tentativamente identificado a nivel de trazas en el aceite esencial de B. palustris.
Abstract
The essential oil composition of the aerial parts from Baccharis palustris Heering (Asteraceae), a highly endangered species, was analyzed by GC/qMS, GC/HRMS-TOF, FT-IR, UV–vis and NMR spectroscopy using 1D and 2D techniques. To our knowledge, this is the first report on the essential oil composition of B. palustris, as well as the first phytochemical study on this plant species. The volatile extracts were obtained from different phenologicals stages of plant, at flowering stage (FS) and vegetative stage (VS), where 51 components were identified accounting for 96.3 % and 99.0 % of the oil, respectively. The oil was rich in polyacetylene compounds (> 75 %), being the main components identified the new natural C9-polyacetylenes 1-nonene-3,5-diyne (here named as baccharisdiyne) (52.7–65.0 %), 1,7(Z)-nonadiene-3,5-diyne [7(Z)-dehydro-baccharisdiyne] (14.4–17.8 %), and 1,7(E)-nonadiene-3,5-diyne [7(E)-dehydro-baccharisdiyne] (1.5–2.4 %). In addition, the known polyacetylenic compounds (Z)-lachnophyllum acid methyl ester (4) (4.3–5.3 %) and (E)-lachnophyllum acid methyl ester (5) (0.2 %) were also identified. Moreover, GC/qMS analysis allowed the identification of other 46 components in the essential oil samples, mainly mono- and sesquiterpenoids. In B. palustris, C9-polyacetylenes probably derive biogenetically from a C10 precursor: baccharisdiyne would be derived from either or both lachnophyllum methyl ester geometric isomers, by enzymatic hydrolysis followed by decarboxylation. Dehydro-baccharisdiynes could be produced by a similar pathway starting from the corresponding matricaria acid methyl ester isomers, one of which was tentatively identified at trace-level in B. palustris essential oil.




Comentarios
Publicar un comentario